Chưa được phân loại
Nhiệt độ sôi nhiệt độ nóng chảy trong đề thi đại học
Nhiệt độ sôi nhiệt độ nóng chảy trong đề thi đại học
1.Các yếu tố ảnh hưởng tới nhiệt độ sôi và nhiệt độ nóng chảy
a) Phân tử khối
Ảnh hưởng của phân tử khối hay chính xác là ảnh hưởng của lực Van der Walls.Lực hút Van Der Walls là một loại lực tương tác yếu, là một loại lực phân tử, sinh ra do sự phân cực tạm thời trong phân tử(do sự dao động của các hạt nhân nguyên tử trong phân tử tạo ra) tạo thành các lưỡng cực điện, nhờ đó sinh ra lực hút tĩnh điện.
 * phân loại
* phân loại+ Lực định hướng : xuất hiện trong các phân tử có cực như dẫn xuất halogen(xem ở momen lưỡng cực)
+ Lực khuếch tán : các phân tử ko cực
*Nguyên tắc so sánh nhiệt độ sôi ,nhiệt độ nóng chảy thông qua phân tử khối:
-Tiêu chí đầu tiên phải xét đến:Các phân tử phải có cấu trúc tương tự nhau: Đó là các dãy đồng đẳng của nhau.
-Tiêu chí tiếp theo: Phân tử nào khối lượng lớn hơn thì phân tử đó có nhiệt độ sôi, nhiệt độ nóng chảy cao hơn.
Ví dụ:+ CH4và C2H6 thì C2H6 cả nhiệt độ sôi và nhiệt độ nóng chảy đều cao hơn CH4
+tonc(C6H5 – CH3 ) > tonc( C6H6)
b) Momen lưỡng cực(µ)(độ phân cực của phân tử)
( áp dụng chính xác cho nhiệt độ sôi,còn nhiệt độ nóng chảy còn phụ thuôc vào cấu trúc phân tử, sự sắp xếp tinh thể trong phân tử)
Xuất hiện khi có sự phân bố điện tích ko đều , có trọng tâm tích điện dương và âm ko trùng nhau , nên xuất hiện lưỡng cực sẽ có nhiệt độ sôi cao ,tan tốt trong các dung môi phân cực
– Phân tử có độ phân cực lớn có nhiệt độ sôi cao hơn
( độ phân cực là mức độ chênh lệch về lực hút trong phân tử khi có nhóm hút electron)
este > xeton > anđehit > dẫn xuất halogen > ete > CxHy
-COO – > C = O > CHO > R – X > -O- > C – H
+Ví dụ:CH4 và CH3Cl , Liên kết C-Cl phân cực về phía Clo(XCl> XC), do đó :µ(CH3Cl) > µ(CH4) do đó t0nc(CH3Cl) > tonc(CH4)
*Bổ xung thêm về độ tan:
Các chất dễ tan vào nhau khi chúng có tính chất ,cấu trúc tương đồng nhau.
-Các chất phân cực dễ tan trong các dung môi phân cực,ít tan trong các dung môi không phân cực: ví dụ như NaCl tan trong nước , không tan trong benzen
-Các chất không phân cực dễ tan trong các dung môi không phân cực , ít tan trong các dung môi phân cực. Ví dụ mỡ dễ tan trong dầu hỏa, không tan trong nước.
d) Lực phân tán London
Ta xét lực này trên khía cạnh nhiệt độ sôi và thường áp dụng trong trường hợp so sánh giữa các đồng phân với nhau:
* Định nghĩa:
Lực này xuất hiện khi momen lưỡng cực tạm thời gây ra do lực cảm ứng từ các phân tử kế cận tiến lai gần nhau.
-Diện tích bề mặt càng lớn thì lực phân tán London càng mạnh tos càng cao.Ta tưởng tượng: 2 mặt tờ giấy ướt áp vào nhau rất khó tách nhau ra , nhưng vo tròn lại rồi để sát vào nhau thì chạm nhẹ nó cũng tách nhau ra.
-Lực phân tán London giải thích cho chúng ta hiện tượng :
+ Đồng phân nào mạch dài hơn(ít phân nhánh hơn ) tiếp xúc nhiều hơn thì nhiệt độ sôi cao hơn.
+ Đồng phân nào phân nhánh nhiều hơn -> càng đối xứng cầu hơn -> lực hút yếu hơn nhiệt -> đội sôi càng thấp:
Ví dụ:
tos(pentan) > tos(isopentan)
+ Đối với đồng phân cấu tạo, các chất đồng phân có cùng loại nhóm chức thì thứ tự nhiệt độ sôi sẽ được sắp xếp như sau: Bậc 1 > bậc 2 > bậc 3 > …
*Về nhiệt độ nóng chảy (so sánh giữa các đồng phân):
Phân tử nào càng đối xứng cầu hơn(phân nhánh hơn), nó càng sắp xếp khít nhau trong mạng lưới tinh thể hơn -> nhiệt độ nóng chảy cao hơn ( ngược với nhiệt độ sôi)
Ví dụ:
tonc(pentan) < tonc(isopentan)
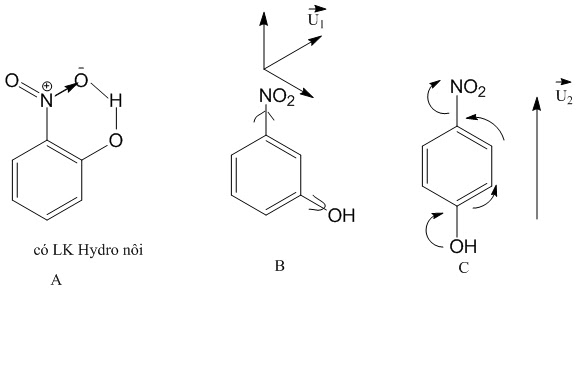
e)Về liên kết hydro
Liên kết hydro giúp các phân tử ràng buộc với nhau chặt chẽ hơn tất cả các liên kết ở trên, do đó về nhiệt độ sôi và nhiệt độ nóng chảy nó cao hơn mặc dù phân tử có liên kết hydro có thể có khối lượng nhỏ hơn.(Chỉ áp dụng nếu sự chênh lệch khối lương phân tử không quá lớn)
*Mô tả nhận dạng liên kết hydro: A-H …X
Trong đó:
-H là nguyên tử hydro
-A: nguyên tử có độ âm điện lớn( N, O,F)
-X:anion (F– , O2-(H2O),N3-(NH3))
*Nguyên tắc so sánh nhiệt độ sôi các phân tử đều có liên kết hydro:
-Phân tử khối cao hơn, nhiệt độ sôi cao hơn
-Nếu cùng là đồng phân: Xem lực phân tán London
-Liên kết hydro nội phân tử nhiệt độ sôi thấp hơn liên kết hydro liên phân tử
Ví dụ: Liên kết hydro nội phân tử là liên kết hydro trong cùng một phân tử.
Vì chất A có liên kết hydro nội phân tử nên chất A có nhiệt độ sôi thấp nhất, chất B và C có liên kết hydro liên phân tử, chất có C momen lưỡng cực lớn hơn B nên nhiệt độ sôi cao hơn: tos(C)> tos(B) > tos(A)
– Liên kết hiđro càng bền, nhiệt độ sôi càng cao
VD: CH3COOH > C2H5OH > C2H5NH2
f) Các hợp chất có liên kết ion thì nhiệt độ sôi, nhiệt độ nóng chảy cao hơn hợp chất có liên kết cộng hóa trị. VD: HCOONa > HCOOH
(các muối của kim loại chứa liên kết ion có nhiệt độ sôi cao hơn các axit tương ứng tạo ra muối đó)
2.Các trường hợp cụ thể
a)Với Hidrocacbon–
Đi theo chiều tăng dần của dãy đồng đẵng ( Ankan , Anken , Ankin , Aren ..) thì nhiệt độ sôi tăng dần vì khối lượng phân tử tăngVD : C2H6> CH4.
-Với các dẫn xuất Đối với dẫn xuất R-X , nếu không có liên kết hidro , nhiệt độ sôi sẽ càng cao khi X hút e càng mạnh. VD: C4H10 < C4H9Cl
– Dẫn xuất halogen của anken sôi và nóng chảy ở nhiệt độ thấp hơn dẫn xuất của ankan tương ứng.
– Dẫn xuất của benzen : Đưa một nhóm thế đơn giản vào vòng benzen sẽ làm tăng nhiệt độ sôi.
b)Với hợp chất chứa nhóm chức 2 chất cùng dãy đồng đẵng chất nào có khối lượng phân tử lớn hơn thì nhiệt độ sôi lớn hơn
VD: -CH3OH nhiệt độ sôi bé hơn C2H5OH
-CH3CHO nhiệt độ sôi bé hơn C2H5CHO
c)Xét với các hợp chất có nhóm chức khác nhau
Nhiệt độ sôi của rượu , Andehit , Acid , xeton , Este tương ứng theo thứ tự sau :- Acid > Rượu > Amin > Andehit
– xeton và Este- Xeton > Andehit
d) Chú ý với rượu và Acid :
Các gốc hút e ( Phenyl , Cl …) sẽ làm tăng nhiệt độ sôi do liên kết Hydro bị tăng phân cực. VD : Cl-CH2COOH > CH3COOH
Tuy nhiên với dẫn chất halogen: Nhiệt độ sôi tăng dần theo khối lương phân tử
Xem nguồn Wiki:
3. Tổng quát: Nguyên tắc chung khi so sánh nhiệt độ sôi
Nguyên tắc 1
Hai hợp chất có cùng khối lượng hoặc khối lượng xấp xỉ nhau thì hợp chất nào có liên kết hiđro bền hơn sẽ có nhiệt độ sôi cao hơn.
Ví dụ 1:
So sánh nhiệt độ sôi củaCH3COOH và C3H7OH.
– Cả hai đều có khối lượng phân tử bằng 60. Nhưng CH3COOH có liên kết hiđro bền hơn liên kết hiđro trong C3H7OH.Nên nhiệt độ sôi của CH3COOH cao hơn nhiệt độ sôi của C3H7OH
Ví dụ 2 :
So sánh nhiệt độ sôi của CH3OH và CH3CHO.
– CH3OH có M=32. CH3CHO có M=44.
CH3OH có liên kết hiđro,CH3CHO không có liên kết hiđro, nên CH3OH có nhiệt độ sôi cao hơn CH3CHO
Ví dụ 1:
So sánh nhiệt độ sôi củaCH3COOH và C3H7OH.
– Cả hai đều có khối lượng phân tử bằng 60. Nhưng CH3COOH có liên kết hiđro bền hơn liên kết hiđro trong C3H7OH.Nên nhiệt độ sôi của CH3COOH cao hơn nhiệt độ sôi của C3H7OH
Ví dụ 2 :
So sánh nhiệt độ sôi của CH3OH và CH3CHO.
– CH3OH có M=32. CH3CHO có M=44.
CH3OH có liên kết hiđro,CH3CHO không có liên kết hiđro, nên CH3OH có nhiệt độ sôi cao hơn CH3CHO
Nguyên tắc 2:
Hai hợp chất cùng kiểu liên kết hiđro, hợp chất nào có khối lượng lớn hơn sẽ có nhiệt độ sôi cao hơn.
Ví dụ 1:
So sánh nhiệt độ sôi của CH3OH và C2H5OH.
– Cả hai đều có cùng kiểu liên kết hidro, nhưng m(CH3OH) <m(C2H5OH ) nên C2H5OH có nhiệt độ sôi cao hơn CH3OH..
Ví dụ 1:
So sánh nhiệt độ sôi của CH3OH và C2H5OH.
– Cả hai đều có cùng kiểu liên kết hidro, nhưng m(CH3OH) <m(C2H5OH ) nên C2H5OH có nhiệt độ sôi cao hơn CH3OH..
Nguyên tắc 3.
Hai hợp chất là đồng phân của nhau thì đồng phân cis có nhiệt độ sôi cao hơn đồng phân trans.(giải thích: Đó là do mô men lưỡng cực.Đồng phân cis mô men lưỡng cực khác 0, đồng phân trans có mô men lưỡng cực bằng 0 hoặc bé hown).
Ví dụ:
So sánh nhiệt độ sôi của cis but-2-en và trans but-2-en.
Ví dụ:
So sánh nhiệt độ sôi của cis but-2-en và trans but-2-en.
Nguyên tắc 4:
Hai hợp chất là đồng phân của nhau thì hợp chất nào có diện tích tiếp xúc phân tử lớn hơn sẽ có nhiệt độ cao hơn hơn.
Ví dụ:
Ví dụ:
Ví dụ: tos(pentan) > tos(isopentan)
Nguyên tắc 5:
Hai hợp chất có khối lượng bằng nhau hoặc xấp xỉ nhau, hợp chất nào có liên kết ion sẽ có nhiệt độ sôi cao hơn.
Ví dụ :
So sánh nhiệt độ sôi của CH3COONa và CH3COOH.
– CH3COONa không có liên kết hiđro nhưng có liên kết ion giữa Na-O; CH3COOH có liên kết hiđro. Nhưng nhiệt độ sôi của CH3COONa cao hơn.
Ví dụ :
So sánh nhiệt độ sôi của CH3COONa và CH3COOH.
– CH3COONa không có liên kết hiđro nhưng có liên kết ion giữa Na-O; CH3COOH có liên kết hiđro. Nhưng nhiệt độ sôi của CH3COONa cao hơn.
Nguyên tắc 6:
Hai hợp chất hữu cơ đều không có liên kết hiđro, có khối lượng xấp xỉ nhau thì hợp chất nào có tính phân cực hơn sẽ có nhiệt độ sôi cao hơn.
Ví dụ:
So sánh nhiệt độ sôi của HCHO vàC2H6.
– Hai hợp chất trên đều không có liên kết hiddro và khối lượng bằng nhau, nhưng HCHO có tính phân cực hơn nên có nhiệt độ sôi cao hơn.
Ví dụ:
So sánh nhiệt độ sôi của HCHO vàC2H6.
– Hai hợp chất trên đều không có liên kết hiddro và khối lượng bằng nhau, nhưng HCHO có tính phân cực hơn nên có nhiệt độ sôi cao hơn.
4.Chú ý khác
Chú ý: Axit > ancol > amin > este > xeton > anđehit > dẫn xuất halogen > ete > CxHy
– Nếu có H2O: t(H2O) = 100oC > ancol có 3 nguyên tử C và < ancol có từ 4C trở lên
|
Chất
|
Nóng chảy
|
sôi
|
Chất
|
Nóng chảy
|
sôi
|
Ka
|
|
CH3OH
|
– 97
|
64,5
|
HCOOH
|
8,4
|
101
|
3,77
|
|
C2H5OH
|
– 115
|
78,3
|
CH3COOH
|
17
|
118
|
4,76
|
|
C3H7OH
|
– 126
|
97
|
C2H5COOH
|
– 22
|
141
|
4,88
|
|
C4H9OH
|
– 90
|
118
|
n – C3H7COOH
|
– 5
|
163
|
4,82
|
|
C5H11OH
|
– 78,5
|
138
|
i – C3H7COOH
|
– 47
|
154
|
4,85
|
|
C6H13OH
|
– 52
|
156,5
|
n – C4H9COOH
|
– 35
|
187
|
4,86
|
|
C7H15OH
|
– 34,6
|
176
|
n- C5H11COOH
|
– 2
|
205
|
4,85
|
|
H2O
|
0
|
100
|
CH2=CH- COOH
|
13
|
141
|
4,26
|
|
C6H5OH
|
43
|
182
|
(COOH)2
|
180
|
–
|
1,27
|
|
C6H5NH2
|
-6
|
184
|
C6H5COOH
|
122
|
249
|
4,2
|
|
CH3Cl
|
-97
|
-24
|
CH3OCH3
|
–
|
-24
|
|
|
C2H5Cl
|
-139
|
12
|
CH3OC2H5
|
–
|
11
|
|
|
C3H7Cl
|
-123
|
47
|
C2H5OC2H5
|
–
|
35
|
|
|
C4H9Cl
|
-123
|
78
|
CH3OC4H9
|
–
|
71
|
|
|
CH3Br
|
-93
|
4
|
HCHO
|
-92
|
-21
|
|
|
C2H5Br
|
-119
|
38
|
CH3CHO
|
-123,5
|
21
|
|
|
C3H7Br
|
-110
|
70,9
|
C2H5CHO
|
-31
|
48,8
|
|
|
CH3COC3H7
|
-77,8
|
101,7
|
CH3COCH3
|
-95
|
56,5
|
|
|
C2H5COC2H5
|
-42
|
102,7
|
CH3COC2H5
|
-86,4
|
79,6
|
5.Một số bài tập
Câu 1. Nhiệt độ sôi của các axit cacboxylic cao hơn anđehit, xeton, ancol có cùng số nguyên tử C là do
A. Axit cacboxylic chứa nhóm C = O và nhóm OH
B. Phân tử khối của axit lớn hơn và nguyên tử H của nhóm axit linh động hơn
C. Có sự tạo thành liên kết hiđro liên phân tử bền
D. Các axit cacboxylic đều là chất lỏng hoặc chất rắn
Câu 2. So sánh nhiệt độ sôi của các chất axit axetic, axeton, propan, etanol
A. CH3COOH > CH3CH2CH3 > CH3COCH3 > C2H5OH
B. C2H5OH > CH3COOH > CH3COCH3 > CH3CH2CH3
C. CH3COOH > C2H5OH > CH3COCH3 > CH3CH2CH3
D. C2H5OH > CH3COCH3 > CH3COOH > CH3CH2CH3
Câu 3. Nhiệt độ sôi của axit thường cao hơn ancol có cùng số nguyên tử cacbon là do
A. Vì ancol không có liên kết hiđro, axit có liên kết hiđro
B. Vì liên kết hiđro của axit bền hơn của ancol
C. Vì khối lượng phân tử của axit lớn hơn
D. Vì axit có hai nguyên tử oxi
Câu 4. Trong số các chất sau, chất có nhiệt độ sôi cao nhất là
A. CH3CHO B. C2H5OH C. CH3COOH D. C5H12
Câu 5. Chỉ ra thứ tự tăng dần nhiệt độ sôi của các chất ?
A. CH3CHO, C2H5OH, CH3COOH C. C2H5OH, CH3COOH, CH3CHO
B. CH3CHO, CH3COOH, C2H5OH D. CH3COOH, C2H5OH, CH3CHO
Câu 6. Cho các chất CH3CH2COOH (X) ; CH3COOH ( Y) ; C2H5OH ( Z) ; CH3OCH3 (T). Dãy gồm các chất được sắp xếp tăng dần theo nhiệt độ sôi là
A. T, X, Y, Z B. T, Z, Y, X C. Z, T, Y, X D. Y, T, Z, X
Câu 7. Cho các chất sau: CH3COOH (1) , C2H5COOH (2), CH3COOCH3 (3), CH3CH2CH2OH (4). Chiều tăng dần nhiệt độ sôi của các chất trên theo thứ tự từ trái qua phải là:
A. 1, 2, 3, 4 B. 3, 4, 1, 2 C. 4,1,2,3 D. 4, 3, 1, 2.
Câu 8. Nhiệt độ sôi của mỗi chất tương ứng trong dãy các chất sau đây, dãy nào hợp lý nhất ?
C2H5OH HCOOH CH3COOH
A. 118,2oC 78,3oC 100,5oC
B. 118,2oC 100,5oC 78,3oC
C. 100,5oC 78,3oC 118,2oC
D. 78,3oC 100,5oC 118,2oC
Câu 9. Chỉ ra thứ tự tăng dần nhiệt độ sôi của các chất ?
A.CH3OH < CH3CH2COOH < NH3 < HCl
B. C2H5Cl < CH3COOCH3 < C2H5OH < CH3COOH
C. C2H5Cl < CH3COOH < C2H5OH
D. HCOOH < CH3OH < CH3COOH < C2H5F
Câu 10. Xét phản ứng: CH3COOH + C2H5OH D CH3COOC2H5 + H2O.
Trong các chất trong phương trình phản ứng trên, chất có nhiệt độ sôi thấp nhất là:
A. C2H5OH B. CH3COOC2H5
C. H2O D.CH3COOH
Câu 11. Cho các chất sau: C2H5OH (1), C3H7OH (2), CH3CH(OH)CH3 (3), C2H5Cl (4), CH3COOH (5), CH3-O-CH3 (6). Các chất được sắp xếp theo chiều nhiệt độ sôi tăng dần là:
A. (4), (6), (1), (2), (3), (5). B. (6), (4), (1), (3), (2), (5).
C. (6), (4), (1), (2), (3), (5). D. (6), (4), (1), (3), (2), (5).
Câu 12. Cho các chất: Axit o – hidroxi benzoic (1), m – hidroxi benzoic (2), p – hidroxi benzoic (3), axit benzoic (4). Các chất được sắp xếp theo chiều nhiệt độ sôi giảm dần là:
A. (4), (3), (2), (1).
B. (1), (2), (3), (4).
C. (3), (2), (1), (4).
D. (2), (1), (3), (4).
Câu 13 Cho các chất: ancol etylic (1), andehit axetic (2), đi metyl ete (3), axit fomic (4). Các chất được sắp xếp theo chiều nhiệt độ sôi tăng dần là:
A. (2), (3), (1), (4). B. (3), (2), (1), (4). C. (4), (1, (2), (3). D. (4), (1), (3), (2).
Câu 14. Cho các chất: ancol propylic (1), axit axetic (2), metyl fomiat (3), ancol iso propylic (4), natri fomat (5). Chất có nhiệt độ sôi thấp nhất và cao nhất tương ứng là:
A. (1),(2). B. (4),(1). C. (3),5). D. (3), (2).
A. H2CO, H4CO, H2CO2 B. H2CO, H2CO2, H4CO
C. H4CO, H2CO, H2CO2 D. H2CO2, H2CO, H4CO.
Câu 16. Cho các chất: Etyl clorua (1), Etyl bromua (2), Etyl iotua (3). Các chất được sắp xếp theo chiều nhiệt độ sôi tăng dần là:
A. (1),(2),(3). B. (2),(3),(1) C. (3),(2),(1). D. (3), (1), (2).
Câu 17. Cho các chất: CH3COOH (1), CH2(Cl)COOH (2), CH2(Br)COOH (3), CH2(I)COOH (4). Thứ tực các chất được sắp xếp theo chiều nhiệt độ sôi tăng dần là:
A. (1), (2), (3), (4).
B. (1), (4), (3), (2).
C. (2), (3), (4), (1).
D. (4), (3), (2), (1).
Câu 18. Cho các ancol: butylic (1), sec butylic (2), iso butylic (3), tert butylic (4). Chất có nhiệt độ sôi cao nhất là:
A. (1). B. (2). C. (3). D. (4).
Câu 19. Cho các hidrocacbon: Pentan (1), iso – Pentan (2), neo – Pentan (3). Các chất được sắp xếp theo chiều nhiệt độ sôi tăng dần:
A. (1), (2), (3). B. (3), (2), (1).
C. (2), (1), (3). D. (3), (1), (2).
Câu 20. Trong các chất sau: CO2, SO2, C2H5OH, CH3COOH, HI. Chất có nhiệt độ sôi cao nhất là:
A. HI. B. CH3COOH.
C. C2H5OH. D. SO2.
Câu 21. Cho sơ đồ:
C2H6 (X) → C2H5Cl ( Y) → C2H6O ( Z) → C2H4O2 (T) → C2H3O2Na ( G) → CH4 (F)
Chất có nhiệt độ sôi cao nhất là
A. (Z). B. (G). C. (T). D. (Y).
Câu 22. Sắp xếp các chất sau theo chiều nhiệt độ sôi tăng dần: C2H5OH (1), C3H8 (2), C3H7OH (3), C3H7Cl (4), CH3COOH (5), CH3OH (6).
A. (2), (4), (6), (1), (3), (5). B. (2), (4), (5), (6), (1), (3).
C. (5), (3), (1), (6), (4), (2). D. (3), (4), (1), (5), (6), (2).
Câu 23. Sắp xếp các chất sau theo thứ tự nhiệt độ sôi giảm dần: ancol etylic (1), metyl axetat (2), etyl amin (3), axit fomic (4), Natri fomiat (5).
A. (1), (5), (3), (4), (2). B. (5), (4), (1), (3), (2).
C. (2), (3), (1), (4), (5). D. (5), (2), (4), (1), (3).
Câu 24. Cho các chất: CH3-NH2 (1), CH3-OH (2), CH3-Cl (3), HCOOH (4). Các chất trên được sắp xếp theo chiều nhiệt độ sôi tăng dần là:
A. (1), (2), (3), (4).
B. (3), (2), (1), (4).
C. (3), (1), (2), (4).
D. (1), (3), (2), (4).
Câu 25. Nhiệt độ sôi của các chất được sặp xếp theo chiều tăng dần. Trường hợp nào dưới đây là đúng:
A. C2H5Cl < CH3COOH < C2H5OH.
B. C2H5Cl < CH3COOCH3 < C2H5OH < CH3COOH.
C. CH3OH < CH3CH2COOH < NH3 < HCl.
D. HCOOH < CH3OH < CH3COOH < C2H5F.
Câu 26. Trong các chất sau chất nào có nhiệt sôi thấp nhất:
A. Propyl amin. B. iso propyl amin
C. Etyl metyl D.Trimetyl amin.
Câu 27. So sánh nhiệt độ sôi cuả các chất sau: ancol etylic (1), Etyl clorua (2), đimetyl ete (3), axit axetic (4), phenol (5).
A. 1 > 2 > 3 > 4 > 5. B. 4 > 5 > 3 > 2 > 1.
C. 5 > 4 > 1 > 2 > 3. D. 4 > 1 > 5> 2 > 3.
Câu 28. Sắp xếp các chất sau theo thứ tự tăng dần nhiệt độ sôi: CH3COOH (1), HCOOCH3 (2), CH3CH2COOH (3), CH3COOCH3 (4), CH3CH2CH2OH (5).
A. 3 > 5 > 1 > 2 > 4. B. 1 > 3 > 4 > 5 > 2.
C. 3 > 1 > 4 > 5 > 2. D. 3 > 1 > 5 > 4 > 2.
Câu 29. Sắp xếp nhiệt độ sôi của các chất sau theo thứ tự giảm dần: ancol etylic(1), etylclorua (2), đimetyl ete (3) và axit axetic(4)?
A. (1)>(2)>(3)>(4). C. (4) >(1) >(2)>(3).
B. (4)>(3)>(2)>(1). D. (1)>(4)>(2)>(3).
Câu 30. Cho các chất sau: (1) HCOOH, (2) CH3COOH, (3) C2H5OH, (4) C2H5Cl. Các chất được sắp xếp theo chiều nhiệt độ sôi tăng dần là:
A. (1) < (3) < (1) < (4) C. (2) < (4) < (3) < (1)
B. (4) < (3) < (1) < (2) D. (3) < (2) < (1) < (4)
Câu 31. Cho các chất: CH3CH2CH2COOH (1), CH3CH2CH(Cl)COOH (2), CH3CH(Cl)CH2COOH (3), CH2(Cl)CH2CH2COOH (4). Các chất được sắp xếp theo chiều nhiệt độ sôi giảm dần là:
A. (1), (2), (3), (4). B. (4), (3), (2), (1).
C. (2), (3), (4), (1). D. (1), (4), (3), (2).
Tải bài viết ở đây: DOWLOAD
(nếu có mật khẩu, mk : forumchemistry)
 Hướng dẫn Download Hướng dẫn Download  Nhấn skipAd ở góc bên phải nếu có Hãy nhấn like nếu bài viết có ích với bạn! Chú ý pass unlock và zipfile (nếu có): chemistry forum ) Nguồn bài viết:http://forum-chemistry.blogspot.com/ |
Nếu bạn thấy thích website Chemistry and Creativity thì đừng ngại click nút “Like” Fanpage hoặc “Follow” trên Google Plus nhé ! Bạn sẽ nhận được thông báo về rất nhiều tài liệu, ebook, giáo trình, video bài giảng của các thầy cô giáo nổi tiếng trên khắp cả nước . Chúc mọi người luôn thành công trong cuộc sống.